El Grupo de Coordinación de Productos Sanitarios publica la versión preliminar del formulario de informe de tendencias del fabricante y documentos de orientación

El equipo de seguimiento y vigilancia poscomercialización del Grupo de Coordinación de Productos Sanitarios (MDCG, por sus siglas en inglés) ha publicado el borrador del formulario de informe de tendencias y los documentos de orientación. Puedes descargarlo aquí.
Estos documentos, junto con las actas de la reunión, fueron publicados en la página web la semana pasada.
NOTA: Todos los documentos enlazados son borradores. No han sido publicados oficialmente en la página web de la Comisión. Aunque las versiones finales pueden diferir, los borradores ofrecen una vista previa de lo que se está desarrollando.
Índice de contenidos
Index of contents
Index du contenu
Inhaltsverzeichnis
Indice dei contenuti
Formulario de Informe de Tendencias del Fabricante (MTR)
El borrador del formulario MTR está disponible aquí.
Este formulario preliminar fue desarrollado para apoyar el futuro Informe de Tendencias en EUDAMED. Sin embargo, se comparte anticipadamente para ayudar a los fabricantes con el informe de tendencias hasta que EUDAMED esté completamente operativo.
Hasta que EUDAMED esté listo, los fabricantes deben enviar el formulario a la Autoridad Competente correspondiente según MDCG 2021-1 (MDR) y MDCG 2022-12 (IVDR).
Una vez publicado oficialmente, la versión del formulario MDR/IVDR reemplazará a la versión MEDDEV.
También se pondrá a disposición de los fabricantes un documento de ayuda para la cumplimentación del formulario MTR.

Imagen extraída de la presentación del Grupo de Trabajo de MDCG titulada «TF TREND REPORT PMSV February 2025».
Guía de MDCG (Preguntas y Respuestas) sobre el Informe de Tendencias
El borrador está disponible aquí.
Ten en cuenta que aún no ha sido publicado oficialmente; de ahí la designación ‘MDCG 2025-X’ en el documento. La versión final puede diferir del borrador.

Imagen extraída de la presentación del Grupo de Trabajo de MDCG titulada «TF TREND REPORT PMSV February 2025».
Los temas tratados incluyen:
- Qué se entiende por una «repercusión significativa en el análisis beneficio-riesgo» y el contexto de un «aumento significativo».
- Cómo gestionar una tendencia relacionada con «efectos secundarios indeseables esperados» o «resultados erróneos previstos».
- Cómo el informe de tendencias está vinculado al plan de PMS y al QMS.
- Qué documentos deben presentarse para el Informe de Tendencias en EUDAMED.
- Cómo los fabricantes deben aplicar los requisitos del informe de tendencias a los productos hechos a medida.
- Ejemplos de cuándo un fabricante debería considerar presentar un informe de tendencias (ver tabla abajo).
| Reglamento | Tipo | Razón de la tendencia | Posible justificación |
|---|---|---|---|
| MDR | Aumento en la frecuencia | Aumento en la frecuencia de erupciones cutáneas causadas por parches adhesivos. | Un aumento estadísticamente significativo en la frecuencia de incidentes no graves, en comparación con la frecuencia indicada en la documentación técnica, puede indicar riesgos para la seguridad del paciente que superan los beneficios previstos. |
| Aumento en la gravedad | Eventos de irritaciones oculares no graves de un producto oftálmico que escalan a abrasiones corneales. | Un aumento significativo en la gravedad de incidentes no graves sugiere una desviación del análisis beneficio-riesgo del producto documentado en la documentación técnica y podría resultar en riesgos inaceptables para la población de pacientes. | |
| Aumento en la frecuencia o gravedad de efectos secundarios indeseables previstos | Eventos de dolor abdominal y náuseas después de la implantación de un espiral anticonceptivo. | Un aumento estadísticamente significativo en la frecuencia o gravedad de efectos secundarios indeseables previstos, en comparación con los niveles anticipados en la documentación técnica, resulta en un riesgo inaceptable para la población de pacientes prevista. | |
| IVDR | Aumento en la frecuencia | Aumento en resultados inválidos de un ensayo de colesterol, donde los ensayos inválidos superan el 5% del total de ensayos. | Un aumento estadísticamente significativo en resultados inválidos impacta el rendimiento del producto en comparación con las especificaciones de rendimiento documentadas. |
| Aumento en la gravedad | Resultados falsos positivos de una prueba de deficiencia de vitamina B12 que conducen a inyecciones innecesarias. | Un aumento en la gravedad de resultados erróneos afecta el análisis beneficio-riesgo, exponiendo a los pacientes a intervenciones innecesarias. | |
| Aumento en la frecuencia o gravedad de efectos secundarios indeseables previstos | Aumento en resultados falsos negativos de una prueba de proteína en orina, causando retrasos en la identificación de disfunción renal en etapas tempranas. | Un aumento estadísticamente significativo en la frecuencia de resultados erróneos esperados en comparación con su rendimiento declarado, lleva a riesgos inaceptables para la población de pacientes en general. |
Tabla replicada del documento de orientación preliminar (pág. 19-20).
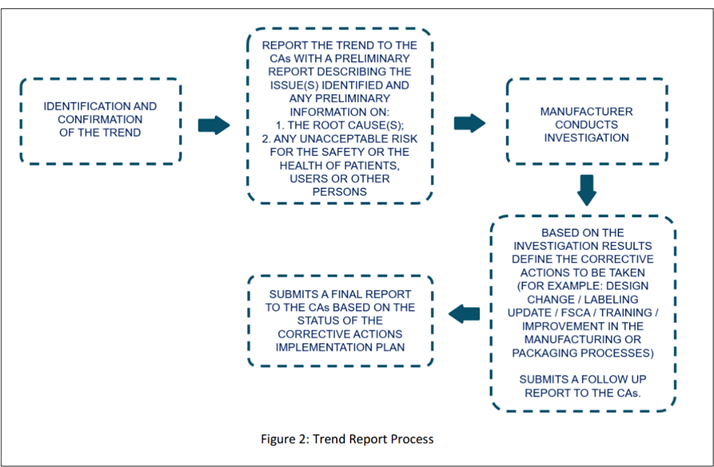
Imagen extraída del documento de orientación preliminar (pág. 15).
Documento de Informe de Tendencias del Fabricante
La versión preliminar está disponible aquí.
Los fabricantes deben usar este documento para proporcionar detalles adicionales que no puedan incluir en el formulario MTR.
Incluye cuatro secciones:
- Descripción de los productos afectados por la tendencia
- Descripción de la tendencia
- Análisis del fabricante sobre la tendencia de la que se informa
- Acción correctiva
La plantilla proporciona orientación tanto práctica (por ejemplo, cómo presentar antes de que EUDAMED esté operativa) como técnica (por ejemplo, tipo y nivel de información esperada).
Informe de Incidente Grave y FSCA
Las actas de la reunión señalan que:
- La Guía de Incidentes Graves está en desarrollo. Este es un nuevo documento sobre las expectativas de la Autoridad Competente y las mejores prácticas. En el momento de la reunión, los comentarios de la Autoridad Competente habían sido consolidados.
- El informe FSCA actualizado está en desarrollo y se espera que se finalice en el tercer trimestre de 2025.

Este artículo ha sido escrito originalmente en inglés por Casus Consulting. Esta versión es una traducción de AbroadLink del original en inglés: El Grupo de Coordinación de Productos Sanitarios publica la versión preliminar del formulario de informe de tendencias del fabricante y documentos de orientación. Puedes acceder al original publicado en el sitio web de Casus Consulting haciendo clic en el título del artículo.



Añadir nuevo comentario