Los organismos notificados en Europa: siempre demasiado pocos frente al desafío MDR/IVDR

Índice de contenidos
Index of contents
Index du contenu
Inhaltsverzeichnis
Indice dei contenuti
- Introducción: la paradoja de una demanda creciente frente a una oferta limitada
- Recordatorio reglamentario: MDR, IVDR y el papel de los organismos notificados
- Algunas cifras clave
- El punto de ruptura: por qué la falta de ON es un riesgo sistémico
- Proyecciones: qué esperar para 2028
- Impactos para los fabricantes y los PRRC/QARA
- Qué se puede hacer para mejorar la situación
- Conclusión: la cuenta atrás ha comenzado
Introducción: la paradoja de una demanda creciente frente a una oferta limitada
Con la entrada en vigor del MDR y del IVDR, todos los fabricantes de productos sanitarios deben pasar por organismos notificados (ON). Cada productos o familia de productos deberá ser certificado conforme al reglamento para poder ser comercializado en el mercado europeo. Sin embargo, el número de estos organismos designados sigue siendo insuficiente para absorber el flujo de solicitudes.
Recordatorio reglamentario: MDR, IVDR y el papel de los organismos notificados
— El reglamento (UE) 2017/745 (MDR) entró en aplicación el 26 de mayo de 2021 y reemplaza las antiguas directivas.
— El reglamento (UE) 2017/746 (IVDR) para los productos para diagnóstico in vitro entra en aplicación en 2022.
— Los organismos notificados son las entidades habilitadas para realizar las evaluaciones de conformidad, especialmente para los productos de clase más alta, evaluar la documentación técnica, auditar los sistemas de calidad, etc.
Algunas cifras clave
Según MedTech Europe, el sector de los productos sanitarios y los in vitro en Europa representa:
- aproximadamente 38 000 empresas;
- más de 500 000 productos en circulación en 2025 (de los cuales al menos el 80 % todavía está bajo las directivas europeas 93/42/CEE y 98/79/CE).
La transición hacia el MDR & IVDR
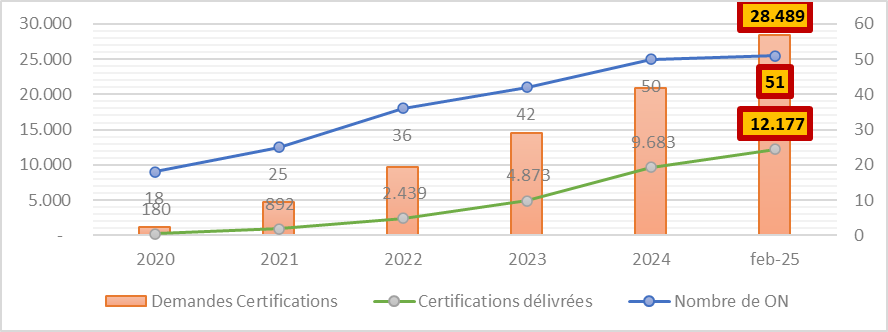
En febrero de 2025, según los datos destacados por la Comisión Europea, los 51 organismos notificados oficialmente designados deben gestionar un número de solicitudes de certificación que asciende a 28 500. En la misma fecha, se han otorgado más de 12 000 certificados, es decir, el 43 %.
Lo que también debes saber:
- un expediente tarda en promedio entre 13 y 18 meses para obtener una certificación;
- los expedientes presentados incompletos alargan este plazo;
- los expedientes pueden ser rechazados y deberán ser presentados nuevamente.
El punto de ruptura: por qué la falta de ON es un riesgo sistémico
— Cuellos de botella: los ON existentes están abrumados por las solicitudes y sus recursos son limitados.
— Complejidad aumentada de las regulaciones: en comparación con las directivas el MDR impone exigencias más estrictas (clínicas, vigilancia poscomercialización, documentación reforzada), lo que incrementa la carga de trabajo por expediente.
— Expedientes incompletos o mal preparados: implica una pérdida de tiempo valioso para los ON y los fabricantes.
— Riesgo de escasez de productos en el mercado europeo si los fabricantes no logran obtener su certificación a tiempo (retraso en el acceso al mercado). Una de las motivaciones de la extensión de los períodos transitorios es precisamente evitar estos retrasos.
— La presión temporal aumenta: con la fecha límite de certificación completa prevista para 2028, el tiempo disponible para las transiciones es cada vez más reducido.
Proyecciones: qué esperar para 2028
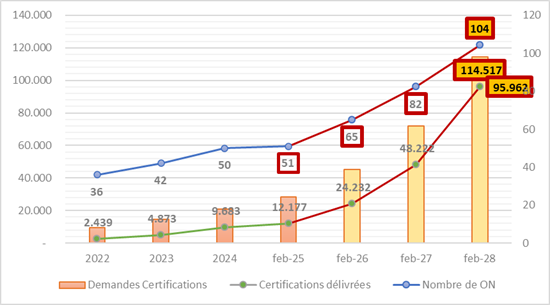
Proyección 1: Basándonos en el ritmo de designación de ON entre 2022 y 2025, se podría esperar pasar de los 51 actuales a aproximadamente 85 ON para finales de 2027 y más de 100 en 2028. Pero esto depende en gran medida de la voluntad política, las inversiones nacionales y las capacidades de acreditación.
Proyección 2: Siempre en base a las evoluciones desde 2022, el número de solicitudes alcanzaría al menos 114 000. Sin embargo, esta cifra debería ser considerablemente mayor, pues aproximadamente 400 000 productos de los 500 000 actualmente en circulación deben pasar bajo el reglamento. Y esto a pesar de los posibles agrupamientos por «familia de productos» (de lo contrario, 1 producto = 1 expediente).
Proyección 3: Según el ritmo actual de certificaciones, se puede estimar que 95 000 certificados serán emitidos en 2028. Esto ni siquiera alcanza el nivel de los 114 000 expedientes posibles en el mejor de los casos.
Resultados de las proyecciones : Si se alcanza efectivamente el número de 104 ON para 2028 y también el número de certificados emitidos, esto representa 919 certificaciones por ON. ¿Es viable ?
Impactos para los fabricantes y los PRRC/QARA
Del lado de las personas encargadas de los asuntos reglamentarios, la presión es palpable. Las diferentes restricciones mencionadas antes (tiempo, presupuesto, exigencias normativas, etc.) les complican la tarea porque:
— la selección de un ON se convierte en un desafío estratégico: disponibilidad, plazos, competencia, tarifas, especialización por tipo de producto;
— una planificación proactiva es indispensable: comenzar con antelación la preparación de los expedientes, aprovechar las auditorías preliminares, asegurarse de que la documentación esté completa y conforme;
— existe un riesgo de retraso en los lanzamientos: un producto listo debe esperar la evaluación del expediente por el ON para entrar en el mercado;
— a veces deben recurrir a ON en el extranjero (por costos o logística);
— saben la importancia de la estabilidad del partenariado con el ON para prever las auditorías de vigilancia, las renovaciones, las modificaciones de alcance, etc.
A pesar de los esfuerzos de las diferentes partes interesadas, la complejidad de las exigencias del reglamento y la falta evidente de ON dificultan la tarea. Los actores del sector, incluidos los propios ON, interpelan regularmente a las autoridades para señalar las carencias estructurales y alertar sobre el efecto de estrangulamiento y de escasez.
Qué se puede hacer para mejorar la situación
En el contexto mencionado antes no existe una solución milagrosa. Si Europa quiere evitar una grave escasez de productos sanitarios, debe actuar rápidamente, especialmente estudiando las siguientes propuestas:
— animar a los Estados miembros a promover y apoyar la designación de ON adicionales;
— armonizar y simplificar ciertas etapas del proceso de evaluación para aligerar la carga administrativa (¿revisando ciertos requisitos?);
— reforzar la formación de auditores expertos MDR/IVDR para aumentar el conjunto de competencias disponibles;
— asegurar la conformidad de la documentación de los fabricantes para evitar desestimaciones administrativas (con explicaciones claras y precisas de lo que se requiere);
— ¿establecer un plazo legal de respuesta para los ON?
— fomentar la colaboración entre ON, agencias nacionales y asociaciones industriales para repartir mejor las cargas de trabajo.
Conclusión: la cuenta atrás ha comenzado
El déficit de organismos notificados en Europa sigue siendo uno de los principales obstáculos para una transición fluida hacia un mercado plenamente conforme a las regulaciones MDR/IVDR. Para los fabricantes, como para los PRRC/QARA, esta realidad impone una estrategia rigurosa, anticipada y resiliente. Si la designación de nuevos ON progresa, debe ir acompañada de un aumento real de la capacidad y de una eficiencia mejorada para evitar el riesgo de un colapso generalizado para 2028.
Últimas cifras actualizadas octubre 2025 :
- Organismos notificados para el Reglamento UE 2017/745 sobre productos sanitarios : 51
- Organismos notificados para el Reglamento UE 2017/746 sobre productos sanitarios para diagnóstico in vitro: 19
Fuentes y referencias
- Comisión Europea – Study supporting the monitoring of the availability of medical devices on the EU market, 2025.
https://health.ec.europa.eu/document/download/59b9d90e-be42-4895-9f6f-bec35138bb0a_en?filename=md_nb_survey_ - MedTech Europe – The European Medical Technology Industry in figures, 2025.
- Comisión Europea – NANDO ( New Approach Notified and Designated Organisations ) Information System.
https://webgate.ec.europa.eu/single-market-compliance-space/notified-bodies
Quizá también te interesen estos otros artículos:

Con formación en Marketing y Comercio Internacional, Alex siempre ha sentido una fuerte atracción por los idiomas y por las diferentes culturas. Originario de Bretaña, en Francia, ha vivido en Irlanda y México antes de volver a Francia y establecerse definitivamente en España. En la actualidad ejerce el cargo de CGO (Chief Growth Officer) en AbroadLink.



Añadir nuevo comentario